河西校区化学组 郑伟
一、三重表征的涵义
化学三重表征教学模式包括3种表征形式:宏观表征、微观表征、符号表征。
宏观表征是指通过物质的物理性质、物质发生变化的现象、物质的客观存在等宏观层面呈现出来的信息对物质进行表征,是物质的外在属性在学习者头脑中的反映。
微观表征是指不能通过直接观察得到的,必须通过物质的微粒组成与结构、微粒的结构、微粒的运动及相互作用、反应机理等微观层面呈现出来的信息对物质进行表征,是物质的结构、组成、反应机理等微观领域的属性在学习者头脑中的反映。
符号表征是指通过表示物质或微粒组成与结构的符号和图形等符号层面的信息对物质或原理进行表征,是化学用语和化学专有符号在学习者头脑中的反映。
如何运用“三重表征”教学模式实施高中化学教学?这是一个值得深入思考的问题,以下是笔者在平时的教学活动中所进行的探索和尝试。
二、三重表征模式的应用
案例1.“离子反应”教学片断
《离子反应》这节课中,课程内容较为抽象,所涉及的是微观层面的离子和离子之间的反应。而高考对这部分内容的要求是学习者能够用离子方程式等化学符号来表征离子反应。笔者为了让学生真正理解离子反应的实质,按照书本的内容,演示了Na2SO4溶液中滴入BaCl2溶液的实验,演示实验过程如图1所示。 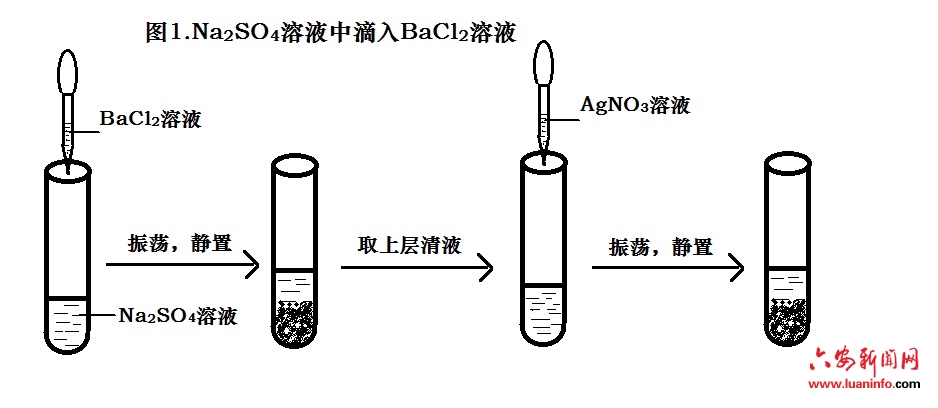
滴入BaCl2溶液后立即生成白色沉淀。学生立即对实验现象呈现出极高的兴趣,笔者顺势提出了问题。
[师]:试管中立即生成白色沉淀,是什么物质呢?
[生]:BaSO4。
[师]:很明显,2ml 1mol∙L-1Na2SO4溶液中滴入2ml 1mol∙L-1BaCl2溶液后,混合溶液中主要存在4种离子,即Na+、Cl-、Ba2+、SO42-。溶液中的Ba2+和SO42-“相见恨晚”,“一拍即合”,形成了BaSO4沉淀,那么Na+和Cl-有没有反应呢?
[生]:反应了;没有反应。(学生很激动,回答有两种结果)
[师]:你们说的不算,我说的也不算,怎么办?
[生]:实验!实验是最高法庭!(学生情绪很高涨)
[师]:那么如何检验溶液中是否还有Cl-呢?
学生在下面嘀咕讨论,有的学生在回忆,然后响起一阵声音。
[生]:用AgNO3溶液。
[师]:很好,下面我们就来检验反应后的溶液中是否还存在Cl-。
教师取出刚才已经静置的试管,将上层清夜倒入另一只试管中,向其中加入几滴稀硝酸,然后滴入1mol∙L-1AgNO3溶液。试管中立即生成白色沉淀,看到此现象,学生们发出“哇”的一声,有的学生还发出感慨“神奇”。
[师]:试管中生成了大量白色的沉淀,说明溶液中的Cl-没有参与反应,考虑到溶液中的离子要遵循电荷守恒原理, Na+也没有参与反应。这样我们就可以对Na2SO4溶液和BaCl2溶液的反应情况进行总结概括。
宏观表征:立即生成白色沉淀。
微观表征:混合溶液中的Na+和Cl-没有反应,而实际上参加反应的是Ba2+和SO42-。
符号表征:化学方程式: Na2SO4+ BaCl2=BaSO4 ↓+2NaCl
离子方程式: Ba2++SO42-= BaSO4↓
教师再让学生体会并总结什么是离子反应,什么是离子方程式,以及如何正确书写离子方程式。
案例2.“Fe3+和Fe2+的相互转化”教学片断
在《Fe3+和Fe2+的相互转化》这节课中,笔者有意将两种离子的检验方法渗透在转化关系中。先向三支干净的试管中各加入2ml FeCl3溶液,依次编号为A、B、C。具体试剂的添加顺序和用量如表1,实验现象如表2。
表1.试剂的添加顺序和用量(从左向右为添加的先后顺序)
|
|
FeCl3溶液 |
还原铁粉 |
KSCN溶液 |
新制氯水 |
|
试管A |
2ml |
—— |
1滴 |
—— |
|
试管B |
2ml |
足量 |
1滴 |
—— |
|
试管C |
2ml |
足量 |
1滴 |
3滴 |
表2.三支试管中出现的现象(从左向右为依次出现的现象)
|
|
FeCl3溶液 |
还原铁粉 |
KSCN溶液 |
新制氯水 |
|
试管A |
棕黄色溶液 |
—— |
溶液立即变成血红色 |
—— |
|
试管B |
棕黄色溶液 |
溶液逐渐变成浅绿色 |
溶液无明显变化 |
—— |
|
试管C |
棕黄色溶液 |
溶液逐渐变成浅绿色 |
溶液无明显变化 |
溶液变成浅红色 |
学生对实验过程中每一次的颜色变化都非常的兴奋和好奇,随后笔者将上述两个表格通过多媒体课件呈现给学生,和学生一起来分析为什么每一支试管中会有不同的现象。
试管A:宏观表征:加入1滴KSCN溶液后立即变成红色。
微观表征:Fe3+和SCN-反应生成红色物质。
符号表征:Fe3++ 3SCN-= Fe(SCN)3
试管B: 宏观表征:加入还原铁粉溶液变成浅绿色,加入KSCN溶液无明显现象。
微观表征:加入铁粉后溶液中已经没有Fe3+,因此不会生成红色物质。
符号表征:2Fe3++ Fe = 3Fe2+
试管C:宏观表征:加入还原铁粉溶液变成浅绿色,加入KSCN溶液无明显现象,滴入氯水后溶液变成浅红色。
微观表征:加入铁粉后溶液中已经没有Fe3+,因此不会生成红色物质,滴入氯水变成红色说明溶液中又生成了Fe3+。
符号表征: 2Fe3++ Fe = 3Fe2+;Cl2+2Fe2+=2Cl-+2Fe3+;Fe3++ 3SCN-= Fe(SCN)3
最后经过整理分析,得出结论:Fe3+和Fe2+可以相互转化,转化关系如图2所示。
对于C试管中最后出现的浅红色现象,笔者有意进行回避,没有作深入探究。
案例3.“原电池原理”教学片断
《原电池原理》这节课学生普遍感觉高度抽象,生涩难懂。若能将演示实验和三重表征模式结合在一起,这节课学生将会很容易理解原电池的工作原理。现将这节课的部分片段摘录如下:
教师先取一个培养皿放在多媒体实物展台上,再向培养皿中放入一粒锌粒,然后取一根事先弯成U形的铜条,将铜条一端搭在锌粒上,另一端用锤子击打成薄片后搭在培养皿内,铜条的中间部分搭在培养皿外,然后向培养皿中加入蒸馏水以浸没铜条的两端为宜。如图3所示 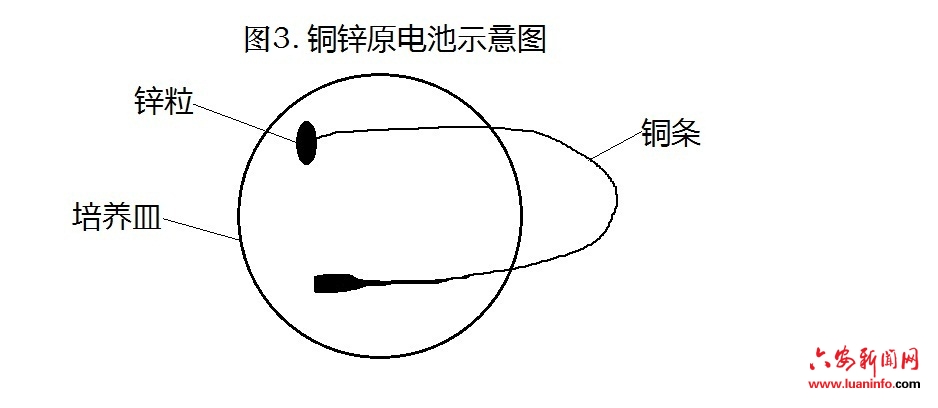
[师]:同学们,仔细观察有没有什么明显现象?为什么呢?
[生]:没有,因为锌与铜和水都不会反应。
[师]:如果老师向水中再加入稀硫酸,会有什么现象呢?同学们可以预测一下。
学生听到预测后都很兴奋,有的回答锌粒上有气泡,有的回答铜片上有气泡(很明显这部分学生预习过),有的回答两端都有气泡。随后教师向培养皿中加入大约2ml稀硫酸,学生都在仔细观察。锌粒上很快产生大量气泡,并且锌粒在慢慢变小,大多数同学都在盯着锌粒观察。过了大约25秒,铜片上开始产生气泡,随后气泡越来越多,越来越明显,有的同学注意到铜片上的现象后,发出了大声的呼喊。其他同学的目光也被他吸引到了铜片上,纷纷发出了“神奇”的感慨,教师顺势提出了问题。
[师]:同学们,你们看到了什么?
[生]:锌粒和铜片上都产生了气泡。
[师]:铜片上为什么会产生气泡呢?这些气体又是什么呢?能不能设法验证啊?
[生]:氢气;氧气;二氧化硫(学生首先想到了这些)
[师]:我们用试管收集铜片上产生的气泡,可以分别用干燥的烧杯、带火星的小木条、品红溶液进行验证。如果老师告诉你,经过验证气体为氢气。你能不能给出合理的解释,为什么铜片上会生成氢气呢?
(部分学生低下了头,有一部分学生在翻书,还有一部分学生在嘀咕:“氢离子”。教师及时对嘀咕的学生给予了肯定)。
[师]:有的同学说到了氢离子,很好,我们一起来分析。在铜片周围存在大量的“游手好闲”的氢离子,现在却变成了氢气,如果从化合价的角度分析,氢离子要想成为氢气必须要获得电子,而铜很稳定,不会失去电子,那么电子从哪里来的呢?很明显在另一端,锌很活泼,并且随着锌的溶解,锌失去了电子,电子顺着这条“蜿蜒的小道”到达了另一端,在这里,“游手好闲”的氢离子得到了电子变成了氢原子,随后结合成为氢气分子,氢气分子聚集在一起就变成了大家看到的气泡。这样一个过程我们可以对锌粒和铜片从三个方面进行概括:
锌粒:宏观表征:锌粒逐渐变小,慢慢溶解;
微观表征:锌很活泼,锌原子失去电子成为锌离子进入到溶液中;
符号表征:电极反应式:Zn-2e-=Zn2+
铜片:宏观表征:铜片上有气泡生成;
微观表征:铜片附近的氢离子得到电子变成氢原子,氢原子结合成为氢气分子;
符号表征:电极反应式:2H++2e-=H2↑
对于锌粒上的现象,笔者会在后续的内容中进行解释。
(张修胜老师编校)
